对于癌症患者,最宝贵的是什么?
是时间!
每个患者都要和时间赛跑,谁跑赢时间,谁等来新药上市,谁就有了生之希望。”
2018年,免疫药物PD-1终于在国内上市,它的到来比美国晚了整整4年。4年,一些人成了幸运儿,一些人却没等过这4年。
然而,上市却不等于同步!
很多人不知道的是,更多更有效的抗癌药物还在大洋彼岸:美国第二代PD-1已经开始临床试验,有效率大幅提高;CAR-T免疫疗法上市近一年,挽救了最晚期的病人;数千项抗癌药物临床试验像一场场接力赛,在帮助患者实现与癌共存……
如今,美国的癌症五年生存率是66%,中国只有30.9%。“药之差”,就是生命的距离。
这哪里是时间,这就是命
2018年6月,我国批准PD-1上市。同月,美国发布第二代PD-1研究数据:有效率达71.4%,是第一代(20%-40%)的两到三倍。
老一代才在国内上市,新一代已在国外取得突破进展。这样的情景似曾相识。2016年,中国终于等来了首个HPV 2价疫苗。同期,美国却宣布该疫苗在上市10年后退市,因为美国已经有了升级版的9价疫苗。
HPV疫苗国人等了10年,PD-1国人等了4年,这哪里是时间,这就是命!每一次等待,不知有多少人最终没有熬过疾病对时间的考验。
时间差距的背后,折射的是对生命的态度。美国医疗投入GDP占比长年维持在17%左右,而我们只有5.5%。美国上市的每一种新药,国人都需平均等待3-5年乃至更长时间。
中美医药差距到底有多大?官方来说,据国家药品监督管理局统计:过去10年间,美欧日上市的新药有415个,在中国上市的只有76个,占比不到20%。
民间来说,有一篇文章这样回答:《美国有最好的药,中国有最好的医药销售》。一方面是美国十大上市药企研发投入80倍于中国十大上市药企;另一方面,是中国销售费用投入最猛的四大药企,每年的研发投入连营收的10%都不到。
此外,据专业咨询机构IQVIA的统计,2012至2016年,全球共首次上市55种抗癌药,其中美国两年内上市的有46个,中国只有4个,甚至低于印度和土耳其。
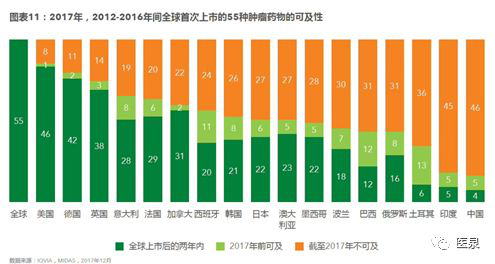
这就是中国抗癌药的现状!
说回PD-1。
即使疗效不俗,但PD-1治疗效果个体差异很大,对多数肿瘤的有效率仅为20%—40%。例如,对有EGFR基因突变的肺癌患者,PD-1不仅效果不明显,反而可能导致部分肿瘤患者癌细胞激增。
为了提高PD-1的有效性,美国在3年前又开始了第二代PD-1的临床研究。相比第一代只能识别癌细胞一种“伪装”,第二代PD-1(代号M7824)却能识别两种。其目标更准,歼敌范围更广,肿瘤缩小或消失的有效率惊人。以非小细胞肺癌为例,第二代PD-1有效率高了一倍不止,达到71.4%。

第二代PD-1抑制剂(M7824)
在2018年ASCO大会上引发关注
在长长的彼有我无的药品名单上,PD-1只是一个缩影。
“无效退款”式的碾压
十分钟,一袋液体,治愈癌症。
这不是神话。
2017年8月,一种“最有可能治愈癌症”的全新疗法在美上市。由于太具“碾压性”,研发方甚至表示可以“无效退款”。
它叫CAR-T。
记得央视前主持人罗京,还有那个漫画被改编为电影《滚蛋吧!肿瘤君》的爱笑女孩熊顿吗?如果在他们患上恶性淋巴瘤的时候能用上CAR-T,也许他们还在继续为大家播新闻,画好看的漫画。
CAR-T有四大颠覆:一是让原来无药可救的晚期血液类肿瘤患者不再必死无疑;二是后续无需骨髓移植、化疗放疗手术等任何折腾;三是每位患者都是个性化定制的治疗药物;四是治疗一月无效,患者可获退款,这是破天荒的第一遭。
目前,CAR-T已经开始向实体瘤进军,未来可能带来肺癌治疗的重大突破。
世界上第一个被CAR-T彻底治愈的白血病患儿名叫Emily。2012年,她白血病复发,所有临床治疗无效,只有等死,主治医生介绍她参加了CAR-T临床试验。
奇迹出现了!
一年后她去复查,已经是one year cancer free,身体里没有任何癌细胞了。后来,每一年她都会拍一张这样的、甜甜的照片,放在她的个人网站上。


被CAR-T治愈的白血病女孩Emily
从原理上看,CAR-T疗法并不复杂,就是利用人体免疫T细胞,在实验室进行基因改造成CAR-T细胞,相当于给T细胞安装上“巡航导弹”,再大量扩增后花上10分钟回输到患者体内,它们就会去寻找并杀死癌细胞。
统计显示,在经过CAR-T治疗三个月后,63名复发难治性白血病患儿中有52人病情得到完全缓解,总体有效率高达83%。
遗憾的是,CAR-T要引进国内连时间表都还没有。与普通的药品不同,即使《我不是药神》能够合法带药,CAR-T这种必须在实验室里操作,个性化改造、扩增患者自身免疫细胞的疗法也没法带。
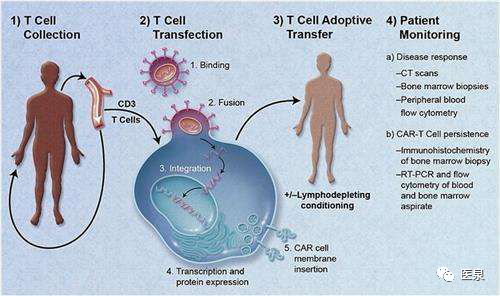
CAR-T疗法的作用原理
不仅是免疫疗法,被誉为开启精准医疗时代的靶向药也面临“时间差”的问题。简单列举几个只有“洋鬼子”有的:
1肺癌靶向药dabrafenib(达拉菲尼)和trametinib(曲美替尼),针对BRAF突变,有效率达到60%以上;
2乳腺癌靶向药Pertuzumab,6年前就开始在美国用于治疗“最凶险”的Her-阳性晚期乳腺癌;
3卵巢癌靶向药Niraparib,用于BRCA基因突变(安吉丽娜茱莉就是这种突变),使患者无进展生存期延长了近3倍!
类似药物还有很多,据国内权威出国看病服务机构盛诺一家统计,在美国获批上市的靶向药物中,仅有约32%在中国上市,还有68%在国内没有上市,一旦耐药国内患者就很可能落入无药可治的残酷局面。
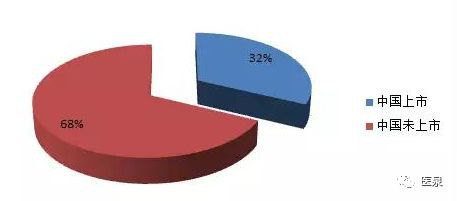
美国已获批靶向药在中国的上市情况
无怪乎有人无奈地说,等一船大豆只要40天,等一盒抗癌药却要几年。
“无药可治”的“最后一搏”
在美国,当医生宣布无药可治时,常常并不代表是“终点”。因为,这些不管多忙都会保证每周至少一到两天实验室研究的医生通常还有另一个身份:某某临床试验的负责人。
他们会告知患者,现在哪些医院在进行哪些临床试验,目前进展到什么阶段。如果适合,他们会建议患者进行入组申请。在美国癌症专科排名第一的MD安德森癌症中心,每天有数百项临床试验在同时进行,甚至超过90%的肿瘤患者都会主动询问医生:“我可以参加新药临床试验吗?”
在医疗科技跃迁式发展的今天,被视为“最后一搏”的临床试验也有可能成为“回天灵药”。
2017年,美国个性化癌症疫苗首次人体试验交出“成绩单”:6名黑色素瘤患者在接注疫苗2年后,4人没有复发。
让人想不到的是,这个神奇疫苗的主要成分竟然是患者自身的肿瘤。研究人员将患者肿瘤中的变异蛋白与药剂混合注入患者体内,激活患者自身的免疫系统,让免疫细胞像警察一样去找到癌细胞,将癌细胞消灭。
也许在未来,癌症能像流感一样,一针疫苗,全部搞定!

媒体对个性化癌症疫苗的报道
在《南方人物周刊》2018年8月报道的《试药者,希望的猎手》一文中,记录了多位中国癌症病人赴美参加临床试验的故事。商人张力就是其中之一。
2016年,张力查出腮腺癌,并且转移到肺部。腮腺癌对化疗不敏感,国内又没有可用的靶向药,他第一时间选择了赴美治疗。在美国MD安德森癌症中心,主治医生把他列为重点病例,因为腮腺癌有很大概率存在融合基因,正适合一种正在临床试验的靶向药。
这种药叫Larotrectinib,又叫LOXO-101,被誉为2017年肿瘤治疗领域的“黑马”。它对存在特定基因融合的17种癌症(包括肺癌、肠癌、黑色素瘤等)有效率高达75%,其中13%的患者达到临床治愈。
张力成功入选了该临床试验。两个月后CT扫描显示肿瘤减小,五个月后肿瘤完全消失。
“在我陪同就诊的经历中,很多时候患者是在跟时间赛跑,如果等到新的药物,生命就可以进一步延长。”陪同张力的盛诺一家海外客服朱毅杰说。

美国MD安德森癌症中心,全球各地的癌症患者都来这里寻求治疗
相比于美国,中国新药研发的落后是不争的事实。根据美国临床试验注册中心的数据,截至2018年9月,全球共有近30万项临床试验登记注册,其中有40%在美国进行,在中国开展的仅占7%。
在现有药物有效的情况下,参加临床试验并非患者首选。然而,一旦患者对肿瘤药物产生耐药,美国的新药临床试验很可能成为他们延续生命之光的最后希望。
后记:
虽然人类目前还没有彻底战胜癌症,癌症在全球范围内仍是危害人们生命健康的重要杀手。但每一种癌症新药、新疗法的突破,都让面临死神召唤的一部分人重新点燃生命的希望。让人惋惜的是,大部分最新最有效的药物和疗法只有美国才有;让人庆幸的是,医疗不分国界,医疗界的每一点进步都是全人类的福音。最关键的是你知道,给生命多一种选择,也许就能重新改写命运。
42个抗肿瘤药将分级管理,O药或被限制使用
国家卫健委发布新型抗肿瘤药指导原则,共涉及7大系统肿瘤、42个治疗药物,其中包括伊马替尼、吉非替尼,以及新上市的O药等。根据该原则,将抗肿瘤药分为普通使用级、限制使用级,普通使用级指的是列入基药、医保目录及国家谈判品种,值得注意的是,限制使用级需副高及以上职称的医师才能处方。O药将被限制使用。
日前,国家卫健委医政医管局发布《关于印发新型抗肿瘤药物临床应用指导原则(2018年版)的通知》。
我们注意到,抗肿瘤药物将分为普通使用级、限制使用级,普通使用级指的是列入基药、医保目录及国家谈判品种,而限制使用级是没有列入上述范围的抗肿瘤药物,该类药品需副高及以上职称的医师才能处方。
该指导原则的发布,意味着正在开展谈判准入的18个抗癌药品,以及新版基药目录将该变一些抗肿瘤药品未来的临床应用命运。而刚刚上市的O药,由于目前不在基药、医保及谈判范围,属于限制使用级。(当然,不排除今后进入目录)
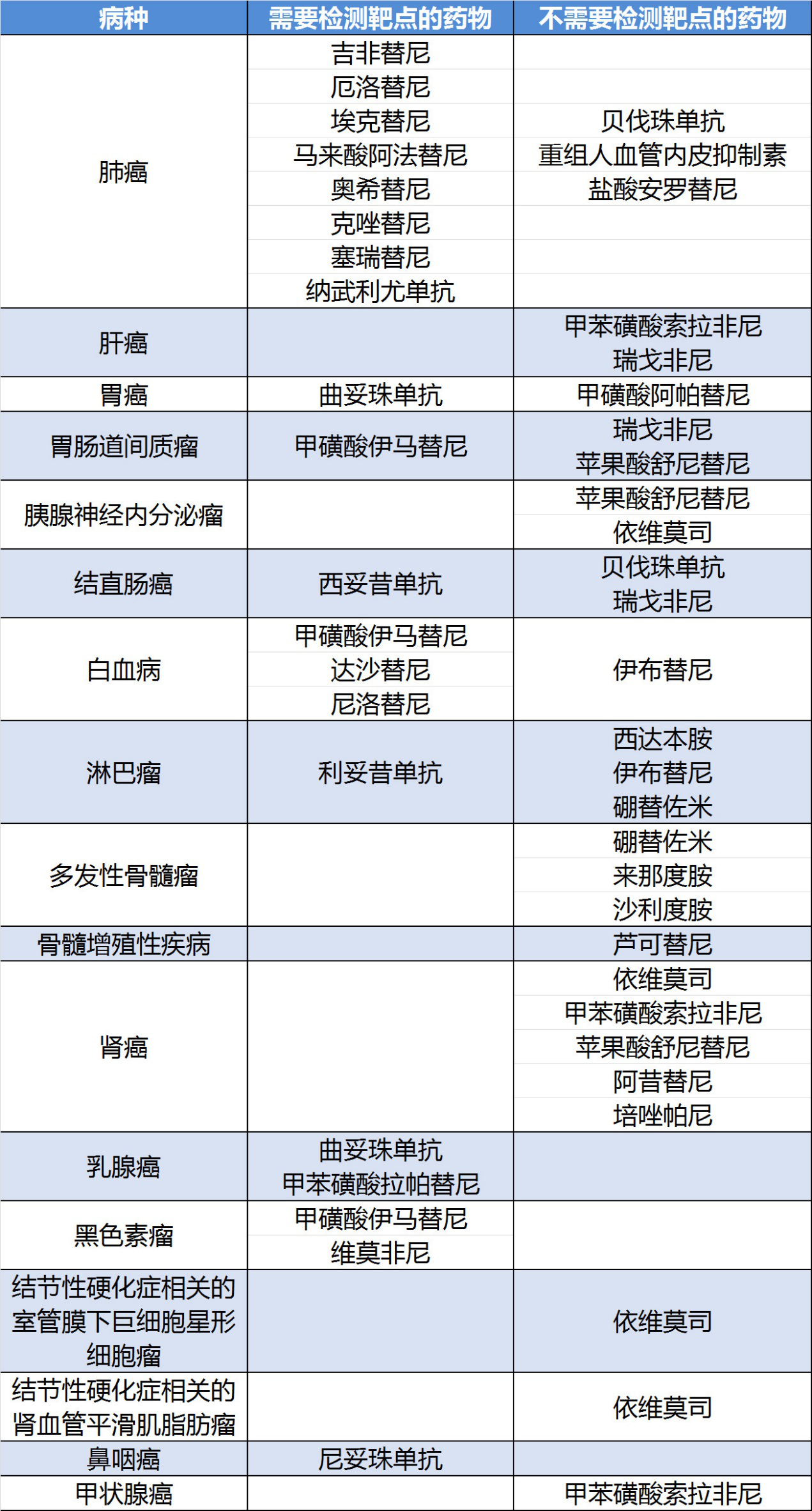
该《指导原则》所说的新型抗肿瘤药物,指的是小分子靶向药物和大分子单克隆抗体类药物,共涉及7大系统肿瘤(呼吸系统、消化系统、血液肿瘤、泌尿系统、乳腺癌、皮肤及软组织肿瘤以及头颈部肿瘤用药),共42个治疗药物。
其中42个治疗药物包括多个重磅抗癌药,如伊马替尼、吉非替尼、埃克替尼,以及西妥昔单抗、曲妥珠单抗和纳武利尤单抗(新上市的O药)等。
该《指导原则》规定,不能随意超适应证使用:
抗肿瘤药物的适应证须国家药品监督管理部门批准,其临床应用须遵循药品说明书,不能随意超适应证使用。
生产厂商,在拥有新的高级别循证医学证据的情况下,应当主动向国家药品监督管理部门申报,及时更新相应药品说明书,保证药品说明书的科学性、权威性和时效性(尤其针对快速优先审批品种)。
另外,根据药物适应证、药物可及性和肿瘤治疗价值,将抗肿瘤药物分成两级:
1.普通使用级:已列入《国家基本药物目录》《国家基本医疗保险药品目录》和国家谈判药品的抗肿瘤药物品种。
2.限制使用级:未列入以上目录的品种。
初级和中级职称的医师具有普通使用级抗肿瘤药物的处方权,副高及以上职称的医师具有限制使用级抗肿瘤药物的处方权。
临床应用限制使用级抗肿瘤药物应当严格掌握用药指征,由具有相应处方权医师开具处方,同时,由具有抗肿瘤药物临床应用经验、具备高级专业技术职称任职资格的抗肿瘤药物临床合理应用专家组审核后使用,抗肿瘤药物临床合理应用专家组可由肿瘤专科医师、抗肿瘤专业临床药师、病理医师等组成。
如特殊情况下越级使用了限制使用级抗肿瘤药物,需在24小时内进行补办手续,并由具备高级专业技术职称任职资格的医师审核。
“特殊情况”:可参考其他国家或地区药品说明书中已注明的用法
考虑到国内现时上市的药品(或获批适应症)尚不能完全满足肿瘤患者的用药需求,在特殊情况下可根据其他国家或地区药品说明书中已注明的用法,国际权威学协会或组织发布的诊疗规范、指南等,来进行临床合理用药;
其中,“特殊情况”具体是指,具有高级别循证医学证据的用法未能及时在药品说明书中明确规定,在尚无更好治疗手段等特殊情况下;
另外,此“特殊情况”只能在以下条件下动用:仅限于三级医院授权的具有高级专业技术职称的医师。
抗肿瘤药使用也要纳入监测
根据《指导原则》,医疗机构应当定期对抗肿瘤药物临床应用基本情况进行监测,监测内容包括:
(1)住院患者抗肿瘤药物使用率和限制使用级抗肿瘤药物使用率;
(2)抗肿瘤药物不良反应报告率;
(3)抗肿瘤药物品种、剂型、规格、使用量、使用金额,抗肿瘤药物占药品总费用的比例;
(4)分级管理制度的执行情况;
(5)临床医师抗肿瘤药物使用合理性评价。
该指导原则的出台,在临床应用层面规范了抗肿瘤药物的使用,不过,对于没有列入到基药、医保目录以及国家谈判的品种来说,未来将会被限制使用,在这其中是否有点感受到了当年“限抗令”的味道?








